第1章 分離培養試験
5 分離培養の対照実験
令和6年1月13日公開
前節で、細胞変性効果の原因が病原ウイルスの他にも存在することを示した。本来ならば、分離培養試験における細胞変性効果が、病原ウイルス以外の原因ではないことを示すために、病原ウイルスを接種しないで分離培養試験を行うことで、細胞変性効果が起こらないことを示さなければならない。いわゆる対照実験である。
しかし、ウイルス学者は対照実験を行おうとしない。そこで、令和3年4月21日にドイツの微生物学者であるステファン・ランカ博士が対照実験を行った。詳細は論文『Präliminäre Resultate der Kontrollversuche (対照実験の結果速報)』に書かれている。当研究所で邦訳した(リンク)ので参照されたい。
対照実験の結果速報
論文の内容について紹介する。
①ヒト上皮細胞を培養する。
健康な初代ヒト上皮細胞を、1倍の抗生物質3種を含む上皮対照培地(CM)で、最適な培養条件下で4継代(継代3~継代6)にわたって培養した。
培養細胞に一般的なVero細胞ではなく、Vero細胞と比較して細胞変性効果が起きにくい「ヒト上皮細胞」を使用している。
具体的な量は不明だが、1単位分の抗生物質3種(①ペニシリン、②ストレプトマイシン、③アンフォテリシンB抗菌剤 )を培養細胞に投与する。
培養細胞を培養するための培地に、上皮低カルシウム培地(CM)を使用している。
上記条件で、培養細胞を4継代にわたって培養しているのだが、ここで重要なのは、この条件では培養細胞は死滅しない、つまり細胞変性効果が起きないことに注意されたい。
②上記培養細胞を4つのグループに分ける。
最初の継代後、細胞プールを4つの群に分けた。CMにおいて3日後、培養物を新鮮なCM(CM、対照1)、10%FCSを添加したDMEM/GlutaMAXに1倍の抗生物質3種(対照2)、またはストレス培地(飢餓1および2)のそれぞれに移植した。1つ目のストレス処理では、DMEM、1%FCS、3倍の抗生物質を含むストレス培地が使用された。2 次と3次の継代は「ブラインド」継代とし、最後の継代からの培養上清の50%を、DMEM、1% FCS、3倍の抗生物質3種を添加した次の継代に移植した。2 つ目のストレス群は、ストレス培地を添加する前に、各継代でさらに全酵母RNA(yRNA)を添加して1時間処理した(飢餓2)。
①の工程で、培養した培養細胞を以下のような4つのグループに分ける。
- 新鮮な培養培地(上皮低カルシウム培地)を使用するグループ。(対照群1)
- ダルベッコ改変イーグル培地(DMEM/GlutaMAX)を使用し、3種類の抗生物質を1回分、10%濃度のウシ胎児血清(FCS)を与えたグループ。(対照群2)
- ストレス処理(盲継代、DMEM、1%FCS、3回分の抗生物質)を行った後、50%の培養上清、1%FCS、3回分の抗生物質を与えたグループ。(飢餓群1)
- 上記ストレス処理を行った後、酵母RNA処理を行ったグループ。(飢餓群2)
対照群1は、培養細胞を培養した時の条件である。
対照群2は、培地をダルベッコ改変イーグル培地(DMEM/GlutaMAX)に変更し、抗生物質の量は培養時と同量とし、10%濃度のFCSを与えている。筆者は細胞培養の経験がないので詳しいことが分からないのだが、FCSを添加したのは培地をDMEMに変更したからかもしれない。
飢餓群1は、培地をDMEMに変更し、培養上清の50%濃度、1%FCS、3単位分の抗生物質を与えている。これは、培養細胞に与える栄養分を制限した上で、抗生物質を3倍にしている。抗生物質は細胞に対して毒性を持ち、その毒物の3倍にすることで毒性を高めている。そして、その毒性から細胞を守る機能を持つFCSの濃度を下げることにより、より毒物の影響を受けやすくなっている。また、FCSは細胞を維持するための栄養分の役割を持っていることから、細胞にとっては維持することが酷な環境に晒されていることになる。
飢餓群2は、飢餓群2と同様の環境で、さらに酵母RNAを加えている。このグループはゲノム決定を目的とした群で、酵母RNAを加えることで、さらに遺伝物質を追加している。これを追加することで、欲しい遺伝子配列を決定しやすくなる。ゲノム決定の詳細については別の章で説明するので、ここでは詳細を省く。
③細胞培養結果
実験結果の画像(図1A)を以下に示す。
この図は、4継代を行った後、4つのグループに分けて、それぞれの条件で培養したときの状態を画像にしたものである。上段が4グループに分けてから3日後、下段が5日後に撮影された画像である。また、左から、対照群1、対照群2、飢餓群1、飢餓群2を表している。
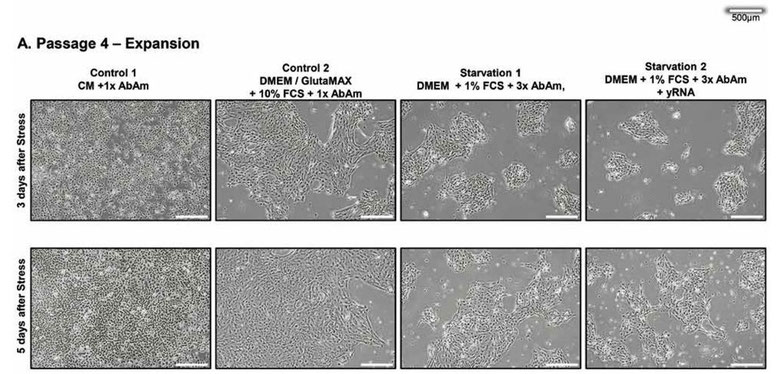
対照群1は、①の工程と同条件であるため、培養細胞は健康のままで、当然細胞変性効果は起きていない。
10%FCSを含むDMEMに移植した後、上皮細胞はCM中よりも平坦な形態をとり、連続した細胞芝を形成したのだが、これはDMEM中のカルシウム濃度が高いためと思われる。それ以外では、細胞は正常に増殖し続けた(図1A)。
対照群2は、培地を変更したこともあり、対照群1にはなかった細胞芝を形成したが、細胞は健康維持し、細胞変性効果は見られなかった。したがって、この条件でも細胞は死滅しないことが分かる。
対照的に、ストレス培地中の細胞芝は増殖が抑制され、小さな島状に縮小し、細胞の変性が始まった。
飢餓群1及び2は、細胞変性効果が始まってきた様子が観察された。
更に続けて2継代、培養した結果(図1B)を以下に示す。
最上段は、対照群2、飢餓群1及び2のそれぞれにグループ分けした直後の画像である。下二段は、図1Aとほぼ同じ意味である。つまり、4継代行い、更に2継代行った合計6継代行った初日、及び5日後の画像である。
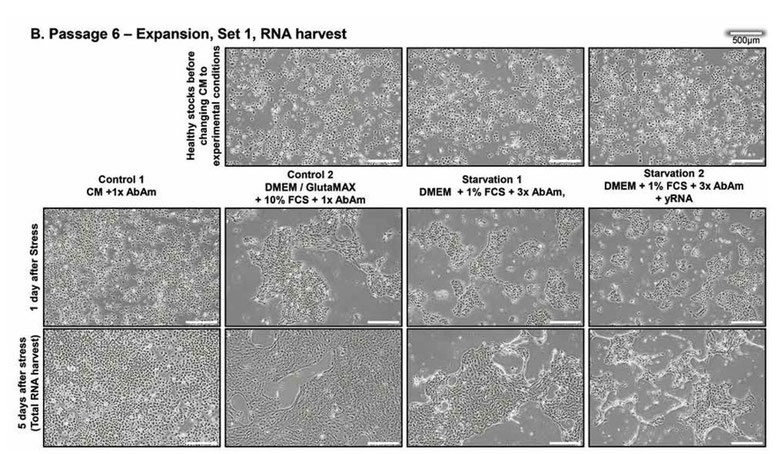
次の2継代では、前の継代でストレスを受けた細胞の上清と培養した細胞は、細胞芝にビリオンに誘導されたプラークを思わせる無細胞領域と、上清中に浮遊する死細胞が増加するCPEを示した(図1B)。
飢餓群1及び2は、細胞変性効果が観察された。すなわち、病原ウイルスを接種しなくても、細胞変性効果が観察されることが、ここで示された。
更に、培養細胞を培養容器の80%以上覆うまで培養した(80%コンフルエント)結果(図1C)を示す。この画像は6継代後、初日及び3日後に撮影した画像である。
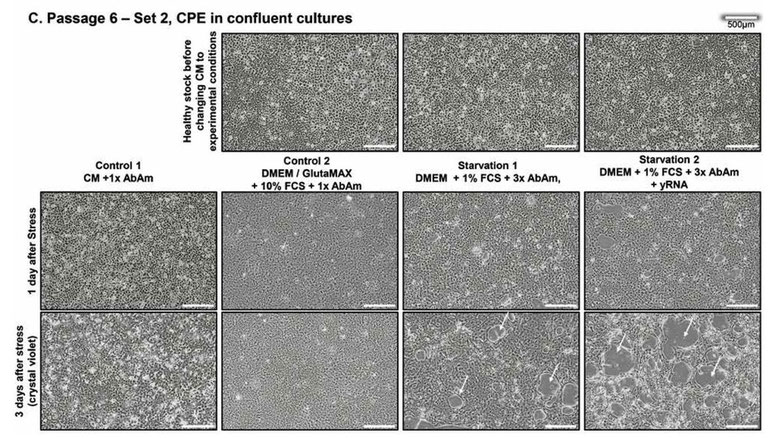
飢餓群1及び2の画像中に示されている矢印の部分が細胞変性効果が起きている部分である。
次に、100%コンフルエントの状態でクリスタルバイオレットで染色した画像(図1D)を以下に示す。この図は、染色した後の3日間の連続画像である。
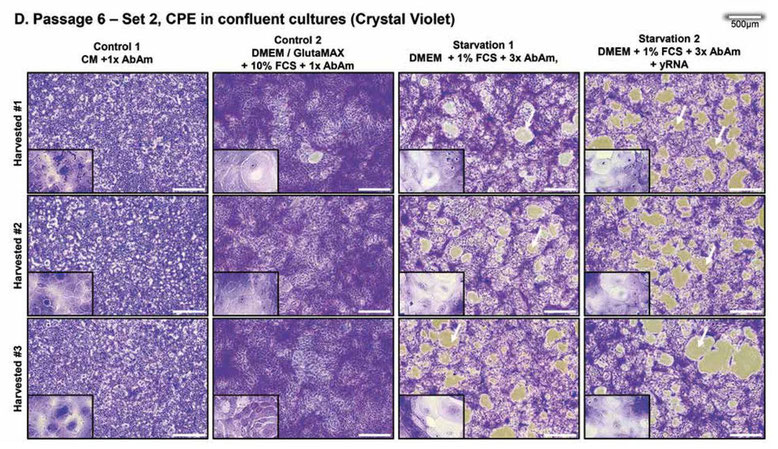
ストレス下のコンフルエント培養(図1C)をクリスタルバイオレットで染色すると(図1D)、明瞭なCPEが確認された。核が凝縮したピクノティック細胞やバルーン化した細胞は、主に飢餓1群で観察され、細胞全体が破壊された領域やプラークも飢餓1群で観察されたが、主に飢餓2群で観察された。
染色すると、細胞変性効果の部分が明らかになり、対照群には細胞変性効果は観察されず、飢餓群にのみ細胞変性効果が観察されることが分かる。
④考察
この対照実験では、一般的なVelo細胞ではなく、Velo細胞よりも細胞変性効果が起きにくい、ヒト上皮細胞を使用している点に注目したい。それでも、病原ウイルスの接種なしで細胞変性効果が観察されるのである。対照実験によって細胞変性効果が起きて欲しくない場合、細胞変性効果が起きにくい細胞を選択するという詐欺的なトリックがあり得るだろう。しかし、今回の場合は、細胞変性効果が起こることを証明したい実験であるのに、細胞変性効果が起こりやすいVelo細胞を選択するのではなく、起きにくいヒト上皮細胞を選択したことに意味がある。
今回の実験でわかることは、2つの変数で細胞変性効果が起こるということである。1つ目は血清の濃度であり、2つ目は抗生物質の量である。
上皮低カルシウム培地を使えば、血清(FCS)は必要なく培養細胞は健康を維持して増殖し続けることが分かる。この培地では、血清を変数に使えない。そこで、対照群2ではDMEMを培地に使用した。恐らく、DMEMを使う理由はそこにあるのかもしれない。DMEMと10%FCSでは、細胞変性効果が確認されないが、1%濃度にすると細胞変性効果が見られることから、10%FCSで培養細胞を培養し、検体を接種した時に濃度を1%程度まで下げて、細胞変性効果を人為的に起こさせるというトリックが考えられる。抗生物質も同様で、1単位量では細胞変性効果が観察されないが、3倍にすると細胞変性効果が観察されることから、検体を接種した時に抗生物質の量を増加させることで人為的に細胞変性効果を起こすトリックが考えられる。
この対照実験により、培養試験における細胞変性効果の原因が検体の接種だけではなく、培養手順にもあることが分かった。実際の分離試験の手順を調査することで、検体接種時に培養条件を変えていないかをチェックすることで、その分離試験の詐欺を見抜くことができるだろう。
まとめ
ステファン・ランカ博士の対照実験により、分離試験のトリックが解明された。以降、実際の分離試験の手順を調べて、イカサマが実際に行われていることを確認したい。



