対照実験の結果速報
(日本語)
原題:「Präliminäre Resultate der Kontrollversuche」
英訳:「Preliminary Results of the Control Experiments」
邦訳:「対照実験の結果速報」
著者:Dr. Stefan Lanka
掲載号:No. 2/2021
対照実験の結果速報
厳格なウイルス増幅条件に対する初代ヒト上皮細胞の反応は、すべてのウイルスとSARS-CoV-2の存在を否定するものである。
概要
エクソソームは、カーゴRNA、DNA、および細胞タンパク質を含む小さな細胞外小胞である。エクソソームはあらゆる種類の細胞で産生され、細胞間のコミュニケーションに役立っているほか、有望な治療機会を提供している。ウイルス学で日常的に用いられる過酷な条件下でRNA種と細胞外小胞を研究するため、健康なヒト初代上皮細胞を、ウイルス(ビリオン)増殖のためのストレスをかけた条件下で、3継代にわたって培養した。ウイルスを接種していないにもかかわらず、細胞は重度の細胞変性効果(CPE)を発現し、その結果、細胞芝に目に見える亜全破壊とプラークが形成された。対照およびウイルス増殖条件下での細胞の盲検法検査によって、異なる形態を100%のヒット率で同定することができた。ストレス群毎に3つの生物学的複製と2つの技術的複製の細胞および細胞培養上清からの全RNAを、同じ最適に培養された細胞からの全RNAと共に次世代シーケンサーで解析した。配列解析と細胞外小胞解析は現在進行中である。
はじめに
分離されたウイルス、例えばコウモリ由来のウイルスは、ATCCの勧告に従って、ダルベッコ改変イーグル培地(DMEM)中の胎仔ウシ血清(FCS)を10%から2%または1%に減少させることによって、栄養物の多くを奪うことにより、過酷な培養条件下で細胞培養により増殖している。栄養物制限はまた、高濃度のギブコの三種抗生物質(ペニシリン/ストレプトマイシン抗生物質とアムホテリシンB抗真菌薬)と、次の細胞培養への細胞培養上清の連続的な「ブラインド継代」と、組み合わせて一般的に行われる⁽¹⁾。形態学的には、ビリオンの増幅は細胞変性効果(CPE)を引き起こし、細胞の丸み、バルーン化、細胞変性に至るのだが、最終的にはコンフルエントな細胞培養におけるプラーク形成によって可視化される。したがって、これらの細胞培養上清から濃縮されたウイルス粒子は、電子顕微鏡で画像化することができる。ウイルス接種を伴わない過酷なストレス条件が、ビリオン様エクソソーム⁽²⁾の形成につながるのではないかという仮説を排除するため、健康な初代ヒト上皮細胞を、一般的なウイルス増殖の手順で培養した。次に、ウイルスRNA分離キットまたは通常のTRIzol抽出を用いて、飢餓状態または対照の細胞および上清から全RNAを回収し、次世代シーケンサーでRNAを解析した。
結果
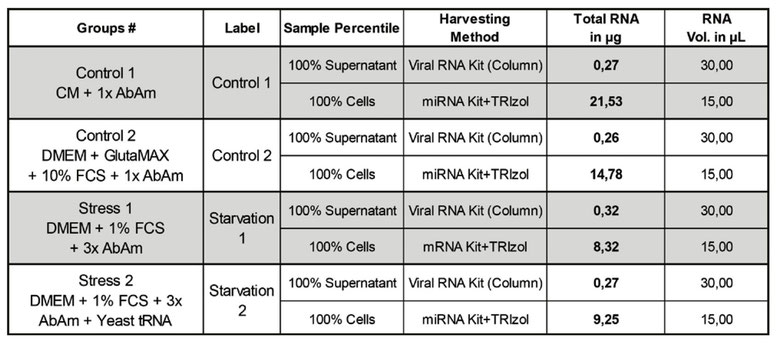
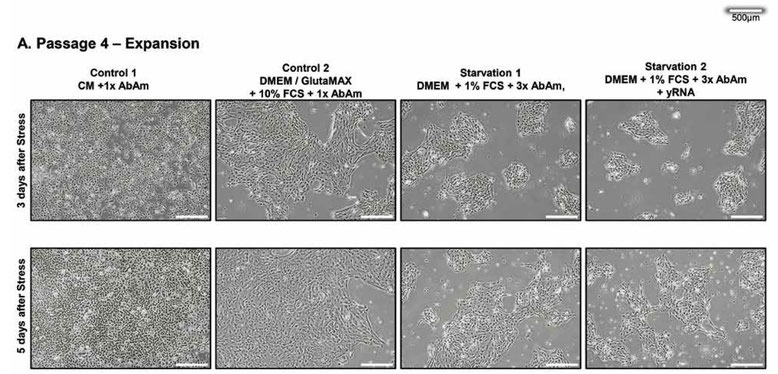
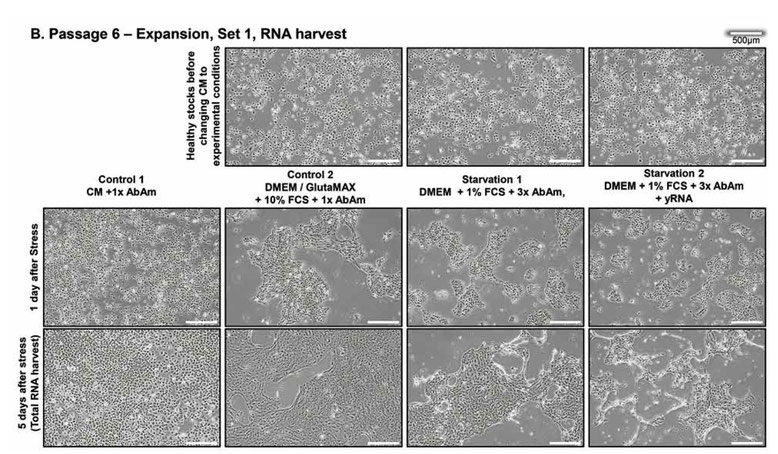
健康な初代ヒト上皮細胞を、1倍の抗生物質3種を含む上皮対照培地(CM)で、最適な培養条件下で4継代(継代3~継代6)にわたって培養した。最初の継代後、細胞プールを4つの群に分けた。CMにおいて3日後、培養物を新鮮なCM(CM、対照1)、10%FCSを添加したDMEM/GlutaMAXに1倍の抗生物質3種(対照2)、またはストレス培地(飢餓1および2)のそれぞれに移植した。1つ目のストレス処理では、DMEM、1%FCS、3倍の抗生物質を含むストレス培地が使用された。2 次と3次の継代は「ブラインド」継代とし、最後の継代からの培養上清の50%を、DMEM、1% FCS、3倍の抗生物質3種を添加した次の継代に移植した。2 つ目のストレス群は、ストレス培地を添加する前に、各継代でさらに全酵母RNA(yRNA)を添加して1時間処理した(飢餓2)。10%FCSを含むDMEMに移植した後、上皮細胞はCM中よりも平坦な形態をとり、連続した細胞芝を形成したのだが、これはDMEM中のカルシウム濃度が高いためと思われる。それ以外では、細胞は正常に増殖し続けた(図1A)。対照的に、ストレス培地中の細胞芝は増殖が抑制され、小さな島状に縮小し、細胞の変性が始まった。次の2継代では、前の継代でストレスを受けた細胞の上清と培養した細胞は、細胞芝にビリオンに誘導されたプラークを思わせる無細胞領域と、上清中に浮遊する死細胞が増加するCPEを示した(図1B)。ストレス下のコンフルエント培養(図1C)をクリスタルバイオレットで染色すると(図1D)、明瞭なCPEが確認された。核が凝縮したピクノティック細胞やバルーン化した細胞は、主に飢餓1群で観察され、細胞全体が破壊された領域やプラークも飢餓1群で観察されたが、主に飢餓2群で観察された。実験は3つの生物学的複製と2つの技術的複製で行った。すべての培養は盲検で行われ、ストレスを受けた培養物は形態の劇的な変化で容易に見分けられた。3回の継代後、対照1、2つのストレス細胞群および上清から、ウイルスRNAキットまたはTRIzolを用いてRNAを回収し、次世代シーケンサーで解析した。回収した全RNAの量は、対照群1で最も多く(表1)、全群で完璧なクオリティであった(データは示さず)。さらに上清を細胞外粒子分析に用いた。実験は現在進行中である。
材料と方法
細胞培養
継代3の市販ヒト初代上皮細胞を解凍し、75cm²のフラスコに4,000細胞/cm²で播種し、定義された上皮低カルシウム培地(FCSなし)に1倍の抗生物質3種(Gibco)(対照培地、CM)を加え、5% CO₂、37℃で増殖させた。80%以上のコンフルエントで、5mlのアキュターゼ酵素を用いて37℃で10分間、膨張細胞を剥離した。アキュターゼを10mlのCMで中和し、細胞を400Gで5分間遠心した後、1mlのCMに再懸濁し、Countess II(ThermoFisher 社製)でトリパンブルー染色して生存している細胞を数えた。細胞は実験用に切り出され、あるいはその後の実験用に平行拡大ラウンドが行われた。
それぞれの実験において、4つの群の健康な初代上皮細胞を、25cm²の培養フラスコに4000細胞/cm²のCMで同じ展開プールから播種し、50%以上のコンフルエントになるまで培養した。培地はその後、4つの実験条件に置き換えた;新鮮なCM(対照1)、またはGlutaMAX、 10%熱不活性化FCS、および1倍の抗生物質3種を添加した市販のDMEM(対照2)により対照細胞を培養した。DMEMを用いたCMに、1%FCSと3倍の抗生物質3種を添加し、栄養物を制限した。これは実質的にビリオン増殖1の実験手順に相当する(Starvation 1 & 2)。ストレスを与えた飢餓群2は、さらに培養フラスコあたり10μgの全酵母RNA(yRNA)で1時間処理し、培地群1および2を交換する前にリン酸緩衝生理食塩水(PBS)で十分に洗浄した。その後、2回の「ブラインド継代」を行い、飢餓群1と2の上清の50%を次の細胞培養に移植した。上清は400Gで5分間遠心分離し、死細胞を除去した。対照群には100%の新鮮な培地を与えた。実験は二重反復で3回繰り返した。最初の生物学的複製で定義されたストレス下の培養期間を、全ての実験において一定に保った。ストレス期間中の培地交換は行わなかった。
継代4:50コンフルエント付近での対照細胞とストレス細胞の培地交換;対照細胞は80%コンフルエント以上まで培養し、ストレス細胞は培地交換後5日間培養した。
継代5:コンフルエント50%以上の対照細胞とストレス細胞における培地交換、コンフルエント80%以上まで培養した対照細胞、培地交換後8日間培養したストレス細胞。
継代6/RNA抽出:コンフルエント50前後で対照細胞とストレス細胞で培地交換;80%コンフルエント以上になるまで培養した対照細胞、培地交換後5日間培養したストレス細胞。
継代6/クリスタルバイオレット:100%コンフルエント時の対照細胞とストレス細胞の培地変化;3日間のストレス導入。
Nikon Eclipse TS100明視野顕微鏡とNikon 1J5カメラ、Nikon FT1アダプター、4倍対物レンズを用い、すべての細胞培養の代表的な画像を毎日1枚、室温で撮影した。
上皮細胞培養液および上清からのRNA抽出
継代6が終了した時点で、全細胞RNAの半分をPromega miRNA- kit (Promega, Z6211)を用いて回収した。このキットは少量および長鎖のRNAサンプルに推奨されており、製造元の手順に従っている。全細胞RNAの残り半分は、標準的なTRIzolの手順を用い回収した。細胞培養上清からの全RNAは、一般的に使用されているQiagen viral RNA kit (Qiagen, 52904)を用いて、製造業者の手順に従って回収した。すべてのRNAサンプルをDNaseで処理した。全RNA濃度、260/280および260/230比は、NanoDrop 2000(ThermoFisher)を用いて決定した。RNA量はCMで培養したサンプルで最も多く、ストレス群1と2で最も少なかったが、上清は非常に少なかったが同程度のRNA量であった(表1)。対照群1、ストレス群1および2から、Bioanalyzerで評価した8.3mgの高品質全RNAを、「次世代RNAシークエンシング」によって塩基配列を決定した。
クリスタルバイオレット染色
最終継代で、細胞変性効果を可視化するため、25cm²培養フラスコの2セット目を8000細胞/cm²で播種した(セット2)。100%コンフルエントになった時点で、これらの細胞を4つの培地条件のうち1つに曝露した。この曝露の3日後、細胞を4%パラホルムアルデヒドで室温にて30分間固定し、さらに1%クリスタルバイオレットで室温にて30分間染色した後、室温にて水道水で十分に洗浄した。Nikon Eclipse TS100明視野顕微鏡にNikon 1J5カメラ、Nikon FT1アダプター、4倍または20倍の対物レンズを取り付け、染色した培養液を画像化した。
参考文献
- Ge, X. Y. et al. Isolation and characterization of a bat SARS-like coronavirus that uses the ACE2 receptor. Nature 503, 535-538, doi:10.1038/nature12711 (2013).
- Gurung, S., Perocheau, D., Touramanidou, L. & Baruteau, J. The exosome journey: from biogenesis to uptake and intracellular signalling. Cell Commun Signal 19, 47, doi:10.1186/s12964-021-00730-1 (2021).
図表
A. 継代4 ― 培養
B. 継代 6 ― 培養、セット1、RNA回収
C. 継代6 ― セット2、コンフルエント培養におけるCPE

D. 継代6 ― セット2、コンフルエント培養におけるCPE(クリスタルバイオレット)

図1.上皮細胞のストレス。継代4と継代6における上皮細胞の4つの実験群の代表的顕微鏡画像。
左から右へ:対照培地(CM)または10%FCSを添加したDMEM/GlutaMAXにおいて、1倍の抗生物質3種を用いた健康な対照細胞;DMEMにおいて、3倍の抗生物質3種と1%FCSを用いてストレスをかけた細胞。
右のパネルの細胞は、培地交換の前に全酵母RNA(yRNA)で1時間処理した。
(A), (B) RNAの回収を目的とした培養中の細胞。3回の継代でCPEがより顕著になることに注意されたい。(B)上段: 培地交換前の細胞。(C), (D) CPEを可視化したコンフルエント細胞; (C)上段:培地交換する前のコンフルエント細胞。(D) 回収時にクリスタルバイオレットで染色した3つの生物学的複製からの細胞培養物。
左の2つのパネルの細胞は連続した細胞芝を形成しているのに対し、右の2つのパネルの細胞は、有意な細胞変性効果に適合するプラーク(矢印)が多数見られ、1日目から5日目にかけて増加していることに注意されたい。酵母RNAで処理した培養では、より大きなプラークの数が有意に多く見られる。
挿入図:倍率20倍;対照培養では、まれにピクノティック細胞やバルーン状の細胞が観察された;ストレス条件1では、細胞質が空のバルーン状の細胞が最も多い。培養物は2人の実験者が100%のヒット率で毎日盲検法で検査した。スケールバー;500μm。全培養:n=3で反復。
表1:RNAの抽出